近日,中源协和细胞基因工程股份有限公司全资子公司武汉光谷中源药业在干细胞新药临床试验及获得美国FDA孤儿药资格认定方面获得新进展。截至目前,该公司自主研发的VUM02注射液已有8个适应症临床试验获批,其中2个适应症获得美国FDA孤儿药资格认定。
12月中旬, VUM02 注射液用于治疗失代偿期肝硬化获国家药品监督管理局(NMPA)核准签发的《药物临床试验补充申请批准通知书》, 同意该品种按照变更后的临床试验方案开展 Ib/II 期临床研究试验;用于治疗活动期中重度溃疡性结肠炎获得NMPA核准签发的《药物临床试验批准通知书》。 VUM02注射液用于治疗急性移植物抗宿主病(aGvHD)获得美国食品药品监督管理局(美国 FDA)授予的孤儿药资格认定,成为国内首款针对治疗急性移植物抗宿主病获批美国FDA孤儿药认定的间充质干细胞产品。

VUM02注射液(人脐带源间充质干/基质细胞注射液)是公司自主研发的冷冻保存型细胞制剂,由经筛选的健康新生儿脐带组织通过体外分离、扩增、收获、冻存后制备,在液氮条件下保存,有效期长。
近年来,中源协和持续加大新药研发力度,推动干细胞技术的研发及转化上市进程,目前干细胞药物申报已取得突破性进展。
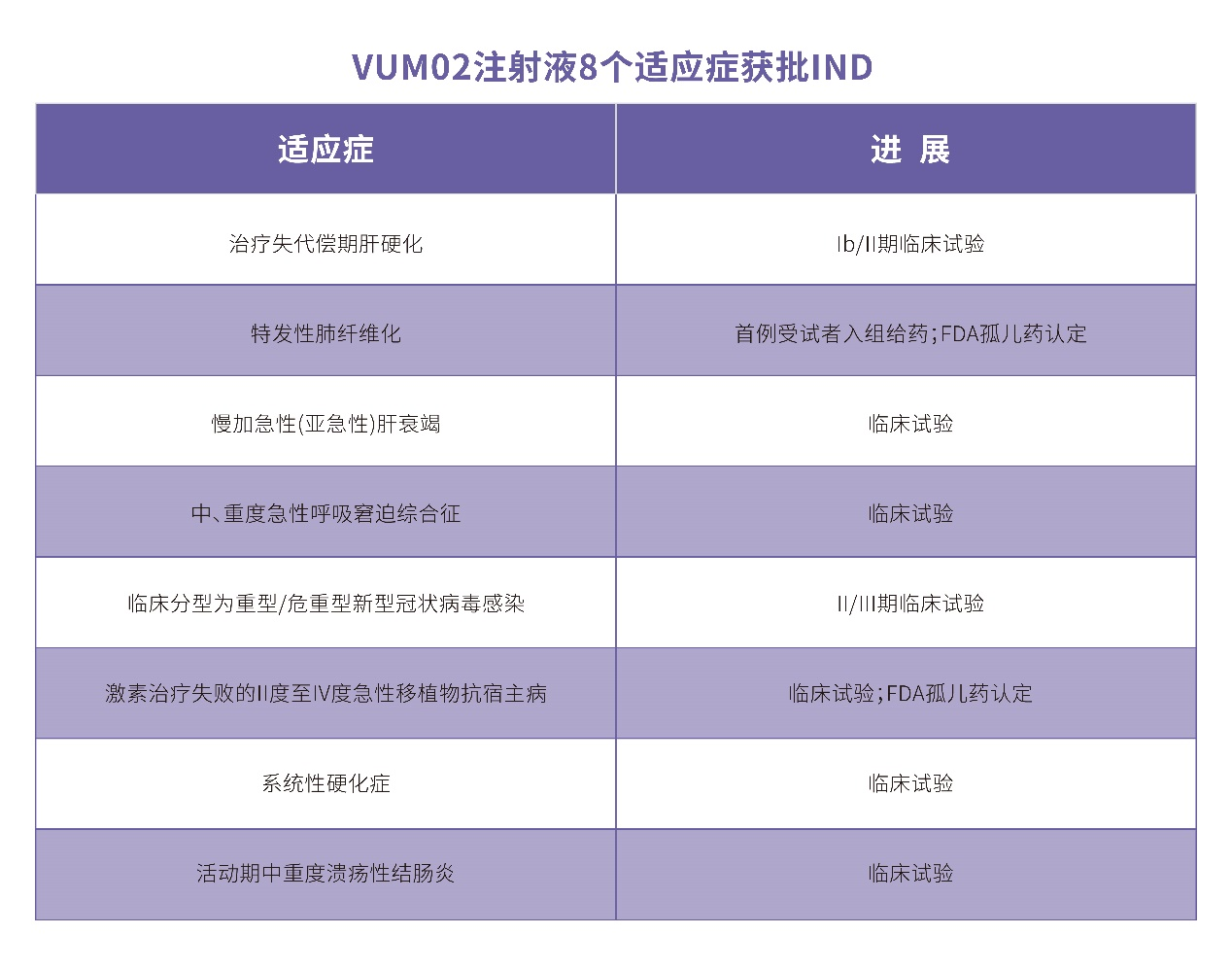
截至目前,中源协和已取得国家药品监督管理局核准签发的8个关于 VUM02 注射液的《药物临床试验批准通知书》,临床拟定适应症包括:失代偿期肝硬化、特发性肺纤维化、慢加急性(亚急性)肝衰竭、中/重度急性呼吸窘迫综合征、临床分型为重型/危重型新型冠状病毒感染、激素治疗失败的II度至IV度急性移植物抗宿主病、系统性硬化症、活动期中重度溃疡性结肠炎;其中治疗临床分型为重型/危重型新型冠状病毒感染获批II/III期临床试验,治疗失代偿期肝硬化获批 Ib/II期临床试验。VUM02注射液用于治疗特发性肺纤维化、急性移植物抗宿主病已获FDA授予的孤儿药资格认定。

为保证细胞治疗产品质量安全,中源协和建立了健全的细胞治疗产品质量管理体系,上线干细胞新药数字化追溯系统,实现从源头到终端的全链条可追溯管理。同时,公司干细胞制剂制备按GMP要求建立了质量管理体系,并获得中国医药生物技术协会颁发的《干细胞制剂制备质量管理合格证书》;在GMP条件下制备的间充质干细胞经中国食品药品检定研究院检测,结果均符合要求,获得了中国食品药品检定研究院出具的脐带间充质干细胞《检验报告》;公司质量评价中心获得中国合格评定国家认可委员会(CNAS)实验室认可;拥有ISO9001质量管理体系、ISO14001环境管理体系及ISO45001职业健康安全管理体系认证证书,干细胞制备、评价及相关服务均得到权威机构鉴定和认证。
未来,中源协和将不断推动细胞药物研发及成果转化,逐步实现从前瞻性研究到确证性试验乃至临床转化及商业化应用的完整科研转化流程,让前沿技术早日惠及更多民众健康!












