
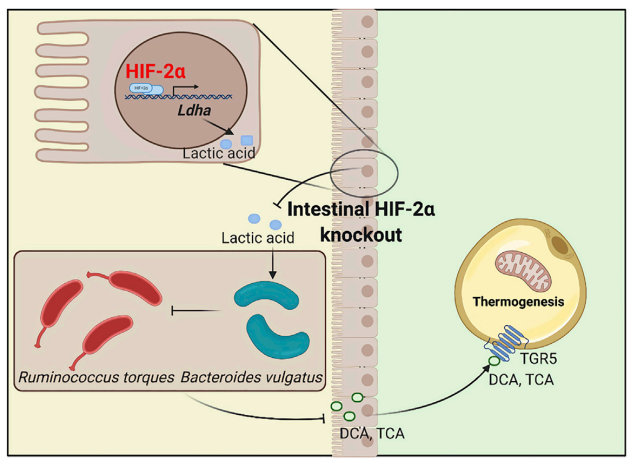
越来越多的证据表明,肠道微生物群在肥胖中起着至关重要的作用,但大多数的研究都集中在肠道微生物群如何通过代谢物影响宿主基因。虽然一些研究表明宿主基因可以影响微生物群,这种效应的潜在机制还需要进一步探索。缺氧诱导因子(HIF)是细胞对缺氧反应的关键调控因子,在调节肥胖中发挥着关键作用。在肥胖发生的过程中,肠道Hif2a信号会被激活。然而,宿主是如何影响肠道菌群?宿主与肠道菌群之间又是如何沟通的?相关的分子机制,仍不清楚。
2021 年 7 月 29 号,北京大学医学部基础医学院姜长涛研究团队在Cell Metabolism期刊在线发表了题为Intestinal-hypoxia-inducible factor 2a regulates lactate levels to shape the gut microbiome and alter thermogenesis的文章。该研究采用集萃药康Gpbar1(Tgr5)-flox小鼠(B6/JGpt-Gpbar1em1Cflox/Gpt),报道了肠道缺氧诱导因子2α (Hif2a)通过调控肠道乳酸脱氢酶A(Ldha)的表达,正向调节肠道乳酸水平。小鼠肠道特异性敲除Hif2a导致乳酸水平降低,普通拟杆菌(Bacteroides vulgatus)减少,扭链瘤胃球菌(Ruminococcus torques)丰度增加。这些变化导致胆汁酸牛磺胆酸(TCA)及脱氧胆酸(DCA)水平升高,并激活脂肪TGR5受体。这种激活上调了解偶联蛋白(UCP) 1和线粒体肌酸激酶(CKMT) 2的表达,导致白色脂肪组织(WAT)产热升高。饲喂TCA和DCA也印证了同样的表型,以及使用B. vulgatus和R.torques定植分别抑制和诱导了产热。这项工作为靶向肠道菌群防治肥胖及其相关代谢疾病提供了潜在的靶点与干预手段。
1、Hif2a肠道特异性敲除调节肠道共生菌的组成和胆汁酸谱
研究者通过宏基因组学测序分析,肠道Hif2a特异性敲除显著改变了小鼠肠道菌群的结构与组成,主要表现为普通拟杆菌的下调以及扭链瘤胃球菌的富集。同时肠道Hif2a特异性敲除会导致各种胆汁酸水平的升高,特别是TCA和T-bMCA (tauro-β-muricholic acid)以及DCA最为显著。

图1. Hif2a肠道特异性敲除可调节肠道共生细菌的组成和胆汁酸谱
2、Hif2a肠道特异性敲除通过降低肠道乳酸水平抑制B. vulgatus生长
研究者通过对Hif2afl/fl与Hif2a△IE小鼠盲肠提取物进行分析,发现敲除小鼠的肠内容物对普通拟杆菌的生长具有明显抑制作用,而对扭链瘤胃球菌的生长没有直接影响。研究者又利用色谱、光谱以及核磁共振技术对小鼠肠内容物进行了活性代谢产物分离及结构鉴定,发现乳酸可以促进B. vulgatus的生长,推测Hif2a△IE小鼠B. vulgatus水平降低可能是由于乳酸缺乏造成的。

图2. Hif2a肠道特异性敲除通过降低肠道乳酸水平抑制B. vulgatus生长
3、Hif2a通过调节Ldha的表达来调节肠道乳酸水平,同时给药乳酸治疗可以逆转Hif2aΔIE小鼠的有益作用
研究者通过检测与乳酸代谢和回肠运输相关上下游基因表达发现,Hif2a△IE小鼠的Ldha的表达水平明显降低。研究者进一步通过荧光素酶报告基因分析显示,Hif2a肠道特异性敲除通过降低宿主Ldha的表达,从而降低了盲肠和回肠内容物中的乳酸水平。研究者后续通过直接直肠给药乳酸后,发现Hif2a△IE小鼠出现体重增长、体脂增加等情况,说明乳酸治疗逆转了Hif2aΔIE小鼠的有益作用。
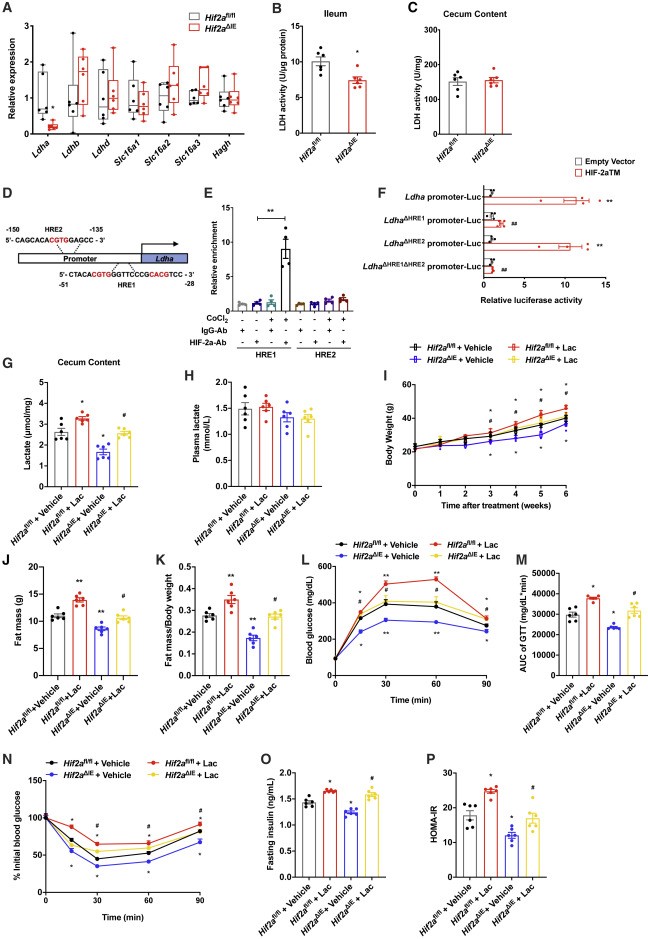
图3. 乳酸治疗可逆转Hif2aΔIE小鼠的有益作用
4、Hif2a肠道特异性敲除通过促进脂肪组织产热来改善肥胖
研究者通过评估实验组和对照组小鼠中的几个产热指标,发现在常温下,两组小鼠的直肠温度相似;但在冷环境下,实验组小鼠的直肠温度则出现了显著升高。进一步研究实验组和对照组小鼠的直肠/腹侧/背侧温度、能量消耗、RER、体外氧耗率以及与肌酸周期相关的生热基因的表达等分析发现,Hif2a△IE小鼠的肠道微生物群主要通过腹股沟脂肪组织中的UCP1以及腹股沟和附睾脂肪组织中的肌酸循环促进产热。

图4. Hif2a肠道特异性敲除小鼠的肠道微生物群可诱导WAT产热
5、Hif2a肠道特异性敲除小鼠的肠道微生物群通过激活WAT中的TGR5来减轻肥胖
研究者通过检测胆汁酸的关键膜受体TGR5的表达模式,发现Hif2a△IE和Hif2a△IE粪菌移植(FMT)小鼠的腹股沟和附睾脂肪组织中TGR5的基因表达显著增强,TGR5的激活导致cAMP水平升高。为了验证脂肪组织中TGR5在Hif2a肠道特异性敲除小鼠中的关键作用,研究者又将Hif2afl/fl 和Hif2a△IE的粪便微生物分别移植到脂肪组织特异敲除Tgr5的小鼠中,发现小鼠的食物摄入量、体重、体脂含量或胰岛素敏感性没有差异。研究结果表明脂肪TGR5信号通路在FMT引起的代谢改善中起着关键作用。
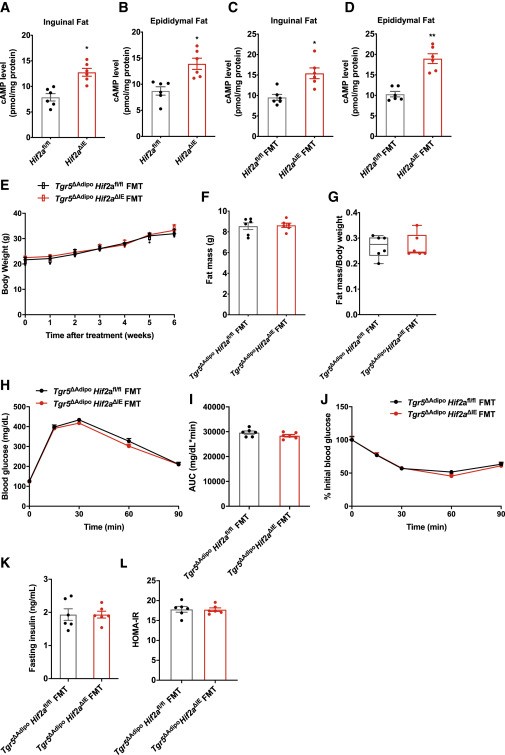
图5. Hif2a△IE小鼠的肠道微生物群通过激活WAT中的TGR5促进产热
6、TCA和DCA通过脂肪TGR5依赖的通路改善肥胖
肠道Hif2a的缺乏增加了小鼠的DCA、TCA和T-bMCA水平,研究者为了进一步探讨了这些胆汁酸中哪一种可以激活TGR5来促进WAT的产热,通过荧光素酶检测发现,TCA和 DCA在体外诱导了TGR5的激活。此外研究者通过连续6周给小鼠喂食 TCA 和 DCA 两种胆汁酸发现,TCA和DCA显著降低了小鼠的体重增加和体脂含量,恢复了葡萄糖不耐受和胰岛素抵抗。
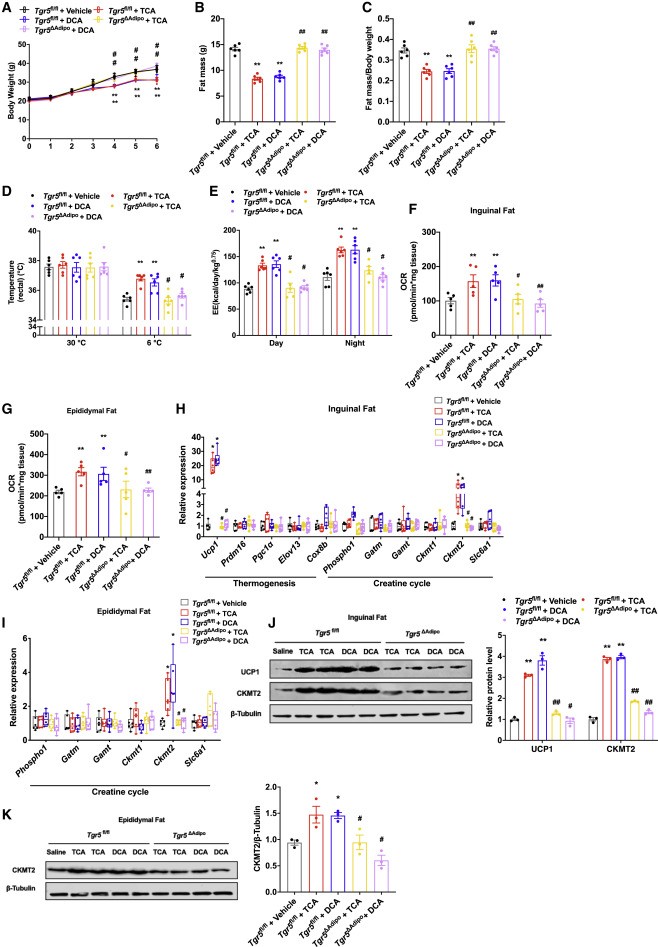
图6. 胆汁酸通过小鼠的脂肪TGR5促进产热
7、B. vulgatus 和 R. torques 通过TCA和DCA诱导的TGR5激活来控制产热
B. vulgatus和R. torques通过灌胃至6周龄小鼠体内,发现B. vulgatus的加入可加速体重增加,体脂含量增加,降低胰岛素抵抗,而补充R. torques则改善了肥胖、葡萄糖稳态和胰岛素敏感性。关于产热作用,B. vulgatus和R. torques对体温、能量消耗、RER和耗氧率(OCR)的影响也是相反的。B. vulgatus和R. torques的改变可能是Hif2a肠道特异性缺失通过胆汁酸-TGR5-UCP1/CKMT2轴诱导WAT产热的主要原因。
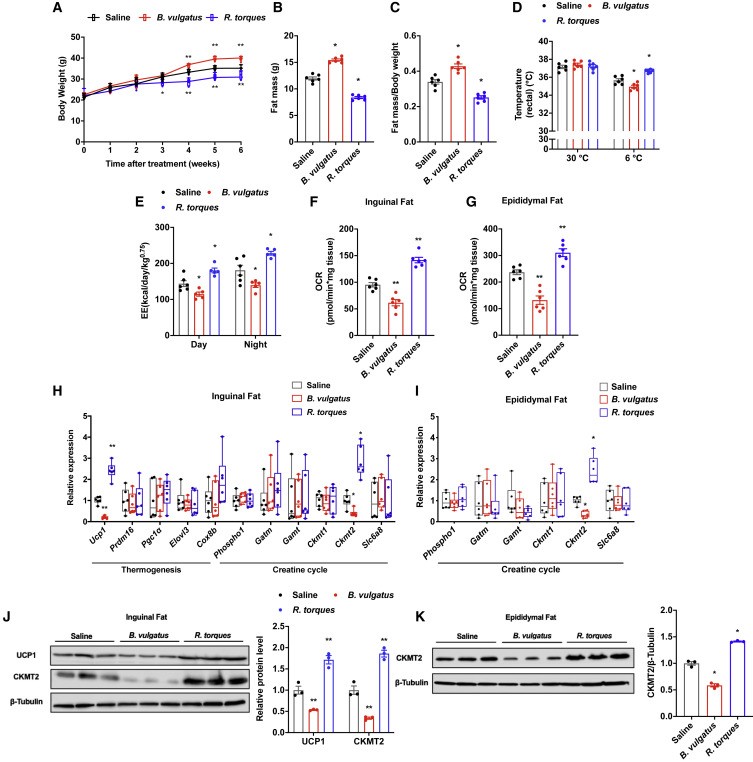
图7. B. vulgatus和R. torques的改变可以调控热产生
总结
研究表明,Hif2a肠道特异性敲除可以通过改变肠道微生物群,从而影响肥胖和肥胖相关胰岛素抵抗的特定机制。Hif2a肠道特异性敲除通过减少乳酸合成改变肠道微生物群,导致普通拟杆菌(Bacteroides vulgatus)的减少以及扭链瘤胃球菌(Ruminococcus torques)的增加,最终通过胆汁酸-脂肪-TGR5轴改善肥胖。
肠道Hif2a通过调节Ldha诱导表达改变B. vulgatus和R. torques之间的平衡,导致DCA和TCA水平降低。它通过脂肪-TGR5引起抑制产热的作用。这些发现加深了人们对宿主基因调控微生物组的机制的理解,并为治疗代谢性疾病提供了一种新的策略。
江苏集萃药康生物科技股份有限公司是一家专业从事实验动物小鼠模型的研发、生产、销售及相关技术服务的高新技术企业,系亚洲小鼠突变和资源联盟企业成员以及科技部认定的国家遗传工程小鼠资源库共建单位。公司基于实验动物创制策略与基因工程遗传修饰技术,为客户提供具有自主知识产权的商品化小鼠模型,同时开展模型定制、定制繁育、功能药效分析等一站式服务,满足客户在基因功能认知、疾病机理解析、药物靶点发现、药效筛选验证等基础研究和新药开发领域的实验动物小鼠模型相关需求。
集萃药康2018年启动了斑点鼠计,划旨在对小鼠基因组中可设计策略的所有蛋白编码和非编码基因逐一进行CKO/KO模型制作,最终形成小鼠全部基因型品系库,实现快速供鼠。当前,斑点鼠总品系数量达22000+,覆盖肿瘤、代谢、免疫、发育、DNA及蛋白修饰等诸多热门领域,满足不同方向科研人员实验用鼠需求。更多品信息需求,请登录集萃药康小鼠商城(gempharmatech.com)搜索。












