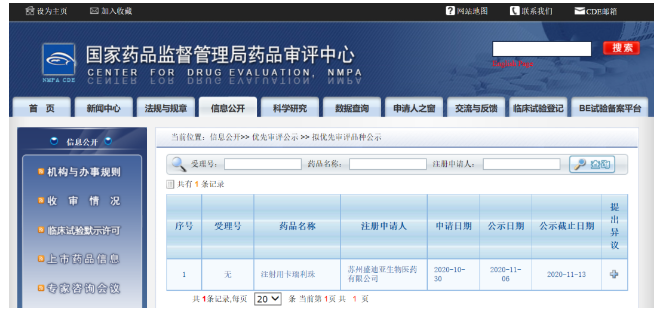
日前,恒瑞医药卡瑞利珠单抗联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗注册申请获国家药品监督管理局受理,并被国家药品监督管理局药品审评,纳入拟优先审评品种公示名单。
鼻咽癌是中国高发肿瘤之一,中国鼻咽癌发病率和死亡率均明显高于世界平均水平,全球50%的鼻咽癌发生在中国。由于鼻咽癌具有明显的地域分布特征,中国南方地区发病率较高,其中广东省鼻咽癌的发病率,。
放射治疗是治疗早期鼻咽癌的主要方法,但大约20-37%的患者会出现局部复发或者远处转移。复发或转移鼻咽癌的治疗手段非常有限,预后较差,含铂双药化疗是目前一线标准治疗的推荐,无进展生存期为7个月左右,中国鼻咽癌患者亟需更有效的治疗手段延长生存期。
卡瑞利珠单抗是恒瑞医药自主研发并具有知识产权的人源化PD-1单克隆抗体,是我国拥有自主知识产权的免疫治疗创新药,自2019年5月上市以来,已相继获批霍奇金淋巴瘤、晚期肝细胞癌、晚期食管鳞癌和非鳞非小细胞肺癌四个适应症。此前,恒瑞医药开展了一项评估卡瑞利珠单抗联合顺铂和吉西他滨对比安慰剂联合顺铂和吉西他滨用于局部复发或转移鼻咽癌一线治疗的有效性和安全性的随机、双盲、安慰剂对照、多,III期临床研究,研究结果表明,卡瑞利珠单抗联合顺铂和吉西他滨一线治疗局部复发或远处转移鼻咽癌患者,较顺铂加吉西他滨的标准一线治疗,可显著延长患者的无进展生存期。
此外,卡瑞利珠单抗用于既往接受过二线及以上化疗后疾病进展或不可耐受的晚期鼻咽癌患者的治疗也被国家药品监督管理局纳入优先审评,未来将为中国鼻咽癌患者提供更多治疗选择。
来源:恒瑞医药